Modelo de michaelis-menten
Modelo que explica la cinética de muchas enzimas (explicación algebraica de la gráfica).
- En este modelo se postuló que la enzima se une con el S de forma reversible, formando el complejo ES, que se descompone en un segundo paso dando la E libre más el P.
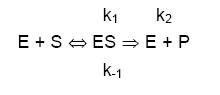
En los primeros momentos de la reacción la concentración de P es muy baja y el modelo supone que la probabilidad de que la enzima reaccione con el producto para volver a formar ES es tan baja que resulta insignificante.
- La V de reacción dependerá de la última reacción
![]()
- En el estado estacionario, la ES es cte, lo que significa que se V de formación tiene que ser igual a la V de desaparición
![]()
- Igualando las dos velocidades
![]()
- Eliminando factor común del primer termino y simplificando el último mediante factor común, nos queda
![]()
- Sumando el término k1 [ES] [S] a ambos lados de la ecuación y Simplificando
![]()
- Despejando ES se obtiene
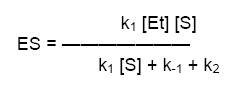
- Dividimos arriba y abajo por k1
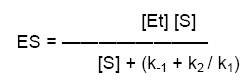
- El término (k-1 + k2 / k1) se define como constante de Michaelis-Menten, Km, sustituyendo en la ecuación anterior
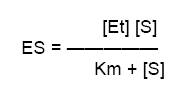
Como la V de reacción en el estado estacionario depende de la ES, V =k2 [ES], se sustituye el valor de ES, obteniéndose
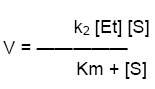
- La Vmax de la enzima se obtiene cuando la totalidad de la enzima se encuentra unida al sustrato, en forma de ES, lo que significa que ES = Et, o sea, Vmax = k2 [Et], que sustituyendo, queda

Esta es la ecuación de MM, es la ecuación de velocidad de una reacción catalizada enzimáticamente con un sustrato. Relación cuantitativa entre la V la Vmax y la S, todos ellos relacionados a través de la Km.
Cuando la V es la mitad de la Vmax se obtiene una equivalencia entre la Km y la S, esto representa una definición muy práctica y sencilla de la Km, que la relación entre constantes de equilibrio.
La ecuación de MM puede transformarse algebraicamente para obtener representaciones rectilíneas en las que las medidas de Vmax y Km sean más precisas. Una de estas transformaciones es la de los dobles recíprocos o Lineweaver-Burk, tomando los inversos en ambos miembros de la ecuación y operando obtenemos.
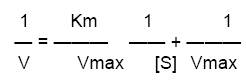
Los parámetros Vmax y Km caracterizan las enzimas denominadas michaelianas, pero incluso para muchas de estas estos datos no proporcionan mucha información así que se usa una constante de velocidad llamada Kcat o número de recambio, que describe la V limitante de cualquier reacción a saturación, es equivalente al número de moléculas de sustrato transformadas en producto en la unidad de tiempo por cada molécula de enzima.
La gráfica de L-B es muy útil para distinguir entre ciuertos mecanismos de reacción enzimáticos y para analizar la inhibición enzimática
Vmax es la velocidad que se alcanza cuando todo el enzima está saturado con el sustrato-
Km se define como la concentración de sustrato a la cual la velocidad de reacción alcanza la mitad de la velocidad máxima.